مواد، از یک یا چند ماده تشکیل شده اندبرخی مواد خالص و بعضی مخلوط اند.
مواد خالص عنصر یا ترکیب اند.
از طرف دیگر مواد ممکن است طبیعی یا مصنوعی باشند.
دانشمندان با مطالعه خواص مواد و ایجاد تغییر در آنها همواره در تلاش اند فراورده های جدیدتر و با کارایی و خواص بهتر را عرضه کنند.
درعلوم عنصرها به سه دسته ی فلز، نافلز و شبه فلز طبقه بندی می شوند.
فلز مادهای است که میتوان آن را صیقل داده و براق کرد، یا به طرحهای گوناگون در آورد و از آن مفتولهای سیمی ظریف تهیه کرد.
فلز جسمی است که آزمایشهای مربوط به گرما و مهمتر از همه جریان الکتریکی را به خوبی هدایت میکند.
فلزات با یکدیگر فرق زیادی دارند، از جمله در رنگ و سختی و نرمی ، تعدادی از آنها ممکن است به آسانی خم شده و یا خیلی محکم و مقاوم باشند
از 109 عنصری که امروزه شناخته شده است، 87 عنصر فلز است.
از فلزها بندرت به شکل خالص استفاده میشود.
معمولا با مخلوط کردن یک فلز با فلزهای دیگر یا غیر فلزها آلیاژی از آن را تشکیل میدهند.
مس :
یکی دیگر از فلزهای پرکاربرد در زندگی است. این فلز براق و سر خ رنگ است.
مس اولین فلز استخراج شده از سنگ معدن است
. فلز مس از طریق ذوب سنگ معدن آن در دمای بالابه دست می آید و نقش مهمی در صنعت دارد.
فلز مس به علت رسانایی الکتریکی زیاد، مقاومت در برابر خوردگی و قابلیت مفتول شدن، کاربرد گسترد های در زندگی امروز دارد.
استفاده از ظروف مسی برای پختن غذا و سیم های مسی در سیم کشی ساختمان نمونه هایی از کاربردهای این فلز می باشند
آهن:
فلزی نسبتاً فراوان در جهان است و اهمیت حیاتی در زندگی حیوانات و گیاهان دارد .
آهن خالص دارای فعالیت شیمیایی زیاد است و مخصوصاً در هوای مرطوب به سرعت زنگ می زند .
عنصر خالص آهن دارای خاصیت واکنش پذیری شیمیایی بالا است و به سرعت زنگ می زند و اکسید می شود.
در هوای مرطوب و خیلی گرم این خاصیت افزایش پیدا می کند.
فلز مس نیز با اکسیژن به کندی ترکیب و به مس اکسید تبدیل می شود.
مس اکسید → گاز اکسیژن + فلز مس
درحالی که اگر یک تکه نوار منیزیم را روی شعله چراغ بگیرید، به سرعت می سوزد
و نور خیره کننده ای تولید ؛ اما طلا برخلاف این سه فلز با اکسیژن ترکیب نمی شود.
فلزات قلیایی به عناصر گروه اول جدول تناوبی گفته میشود .
این عناصر شامل فلزهای لیتیم، سدیم، پتاسیم، روبیدیم، سزیم و فرانسیم میباشد.
واکنش پذیری این عناصر با آب :
از بالا به پایین، به شدت واکنش با آب افزوده میشود.
لیتیم به آرامی با آب واکنش داده و حبابهای هیدروژن آزاد میکند.
سدیم بشدت و همراه با مشتعل شدن با آب واکنش نشان داده و با شعله نارنجی میسوزد.
پتاسیم در اثر برخورد با آب به شدت مشتعل شده و با شعله بنفش میسوزد.
سزیم در آب ته نشین شده و به سرعت تولید هیدروژن میکند.
آزاد کردن هیدروژن همراه با ایجاد امواج ضربهای شدید است که میتواند باعث شکستن محفظه شیشهای شود.
نافلز
این عناصر از نظر تعداد اتم در مولکول هایشان به سه دسته نافلزات دواتمی و نافلزات چند اتمی و گازهای نجیب تقسیم می شوند.
نافلزات دواتمی:
این نافلزات شامل هفت عنصر یعنی تمامی هالوژن ها وعناصر دواتمی اکسیژن و نیتروژن و هیدروژن است.
این عناصر رسانای بسیار ضعیف برق اند ولی بسیار الکترون گیر بوده ودر ترکیبات یونی پیوندهای محکمی تشکیل می دهند.
نکته دیگر این است که ازمیان این عناصر برم به حالت مایع و ید به حالت جامد در دمای اتاقند.
نافلزات چند اتمی:
این نافلزات شامل عناصر کربن و سلنیم و گوگرد و فسفر است.
تمامی این نافلزات در دمای اتاق به حالت جامدند.
این عناصر مولکولهایی بیش از دواتم تشکیل میدهند.
کربن می تواند جامدهای کووالانسی غول آسایی مانند گرافیت و الماس بسازد.
این عناصر نسبت به گروه بالا رسانای بهتری برای برق اند
مثلا گرافیت یک ماده نیمه رساناست.
این گروه نسبت به گروه اول عدد الکترون گیری کمتری دارندو بنابراین بیشتر تمایل دارند تا الکترون های خودر ابه اشتراک بگذارند وپیوند کووالانسی تشکیل دهند.
اگرچه عدد الکترونگیری آنها نسبت به فلزات بسیار بیشتراست.این گروه در ایجاد چرخه حیات بسیار نقش مهمی دارندوکربن ماده اصلی سازنده مولکول های زیستی است.این گروه دمای ذوب و جوش بسیاربالاتری نسبت به گروه اول دارند.
گازهای نجیب:
گازهای کمیاب یا گازهای بیاثر که بیبو و بیرنگ هستند.
به عنصرهای هلیوم، نئون، آرگون، کریپتون، گزنون، رادون و آناناکتیوم گفته میشود که همه در دمای اتاق گازی هستند .
گازهای نجیب در گروه A8 جدول مندلیف قرار دارند.
به استثنای هلیوم، تمام گازهای نجیب دارای آرایش الکترونی خارجی ns2 np6 هستند که آرایشهای بسیار پایدارند.
تمامی این گازها تک اتمی هستند و به مقدار کم در اتمسفر یافت میشوند. (تنها حدود یک درصد حجم هوا را تشکیل میدهند).
در بین گازهای بیاثر، رادون عنصری رادیواکتیو و خطرناک است.
اکسیژن :
یکی از گازهای تشکیل دهنده هواست.
این گاز در هوا به صورت مولکول دو اتمی و به حالت عنصری وجود دارد
. ماده ی دیگری به نام گاز اوزون با فرمول O3 در لایه های بالایی زمین وجود دارد.
گاز اوزون از رسیدن پرتوهای پرانرژی و خطرناک فرابنفش به زمین جلوگیری می کند و به صورت یک لایه ی محافظ عمل می کند.
عنصر اکسیژن علاوه بر کاربرد برای تنفس جانداران به صورت گاز O2 نقش مهمی در صنعت دارد. این عنصر در ساختار بسیاری از ترکیب ها وجود دارد.
یکی از این ترکیبها، سولفوریک اسید با فرمول H2SO4 است.
در فرمول شیمیایی سولفوریک اسید H2SO4علاوه بر عنصرهای H و O، عنصر گوگرد با نشانهی شیمیایی S شرکت دارد.
نیتروژن :
عنصر مهم دیگر در هوا نیتروژن است که به صورت گاز دو اتمی نیتروژن N2 یافت می شود.
نیتروژن یا ازت یکی از عناصر شیمیایی در جدول تناوبی است که نماد آن N و عدد اتمی آن ۷ است.
نیتروژن معمولاً به صورت یک گاز، غیر فلز، دو اتمی بی اثر، بیرنگ، بیمزه و بیبو است که ۷۸٪ جو زمین را دربر گرفته و عنصر اصلی در بافتهای زنده است.
نیتروژن ترکیبات مهمی مانند آمونیاک اسید نیتریک و سیانیدها را شکل میدهد.
نیتروژن یک بخش اساسی در ساختمان همه موجودات زنده است.
نیتروژن در پروتئین ها، واحدهای ساختاری و شیمیایی همه موجودات زنده ، و در مولکولهای DNA ، که دستورات راهنمای ضروری برای همه فعالیتهای زندگی را حمل می کنند ، یافت می شود.
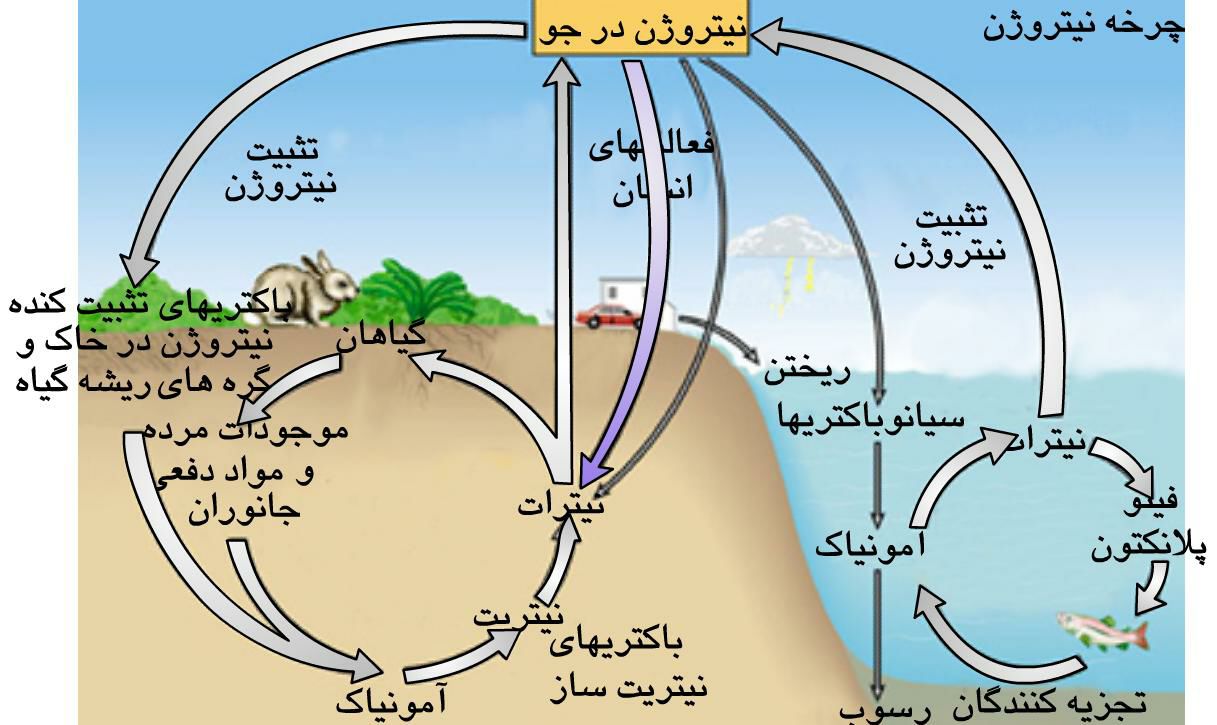 1
1هر چند نیتروژن 78 درصد اتمسفر را تشکیل می دهد ، حیوانات و گیاهان نمی توانند مستقیماَ از آن استفاده کنند.
باکتریهای موجود در خاک در رابطه با چرخه مجدد نیتروژن از طریق تبدیل آن به شکلی که برای موجودات زنده دیگر قابل استفاده باشد ، نقش حیاتی بازی می کنند.
هنگامی که گیاهان و حیوانات می میرند ، باقیمانده اجساد انها بوسیله موجودات ذره بینی موجود در خاک ، تجزیه می شود و ترکیبات نیتروژن درست می شود.
فسفر و کربن عنصرهای نافلز دیگری هستند که در صنعت کاربرد وسیعی دارند
کربن :
عنصری شیمیائی در جدول تناوبی با نشان C و عدد اتمی ۶ است.
کربن عنصری غیر فلزی و فراوان، چهارظرفیتی و دارای چندین دگرشکل میباشد، از جمله:
الماس :
سختترین کانی شناخته شده و دارای بالاترین سرعت صوت و رسانایی گرمایی در میان مواد
گرافیت :
یکی از نرمترین مواد است که در نوک مداد از ان استفاده شده است و تنها نافلز رسانا (ضعیف) است.
دوده چراغ از سطوح کوچک گرافیت تشکیل شده است.
این سطوح بصورت تصادفی توزیع شده، به همین دلیل کل ساختمان آن همسانگرد (ایزوتروپیک) است.
الیاف کربن شبیه کربن شیشهای میباشند.
تحت مراقبتهای ویژه (کشیدن الیاف آلی و کربنی کردن) میتوان لایههای صاف کربن را در جهت الیاف مرتب کرد.
هیچ لایه کربنی در جهت عمود بر محور الیاف قرار نمیگیرد.
نتیجه الیافی با استحکام بیشتر از فولاد میباشد. کربن در تمامی جانداران وجود داشته و پایه شیمی آلی را تشکیل میدهد.
فسفر :
یک عنصر شیمیایی جدول تناوبی است که نماد آن P و عدد اتمی آن 15 میباشد.
فسفر یکی از نافلزات چند ظرفیتی گروه نیتروژن بوده است .
فسفر معمولا در سخره ها و کانی های فسفاتی و همچنین در تمام سلولهای زنده یافت می شود.
فسفر هیچگاه به صورت طبیعی تنها و بدون ترکیب با عناصر دیگر وجود ندارد.
فسفر بسیار واکنش پذیر بوده و هنگام ترکیب با اکسیژن نور کمی از خود ساتع می کند.
از عناصر لازم و حیاتی ارگان های زنده بوده و نامش به شکلهای گوناگون ذکر می شود.
مهمترین استفاده فسفر در تولید کود می باشد.
همچنین در تولید مواد منفجره کبریت آتش بازی مواد حشره کش خمیر دندان و مواد شوینده و همچنین مانیتورهای کامپیوتر نیز کاربرد دارد.
فلوئور :
یکی از موادی است که به خمیردندان می افزایند تا از پوسیدگی دندان جلوگیری شود.
این عنصر در مدار آخر خود 7 الکترون دارد.
کلر Cl نیز از نظر تعداد الکترون مدار آخر مشابه فلوئور است.
طبقه بندی عنصرها :
دانشمندان نیز عنصرها را طبقه بندی می کنند.
طبقه بندی، مطالعهٔ عنصرها را آسان تر می سازد؛ زیرا عنصرهایی که در یک طبقه قرار می گیرند، خواص نسبتاً مشابهی دارند.
یکی از ویژگی هایی که می توان براساس آن عنصرها را طبقه بندی کرد، تعداد الکترو نهای مدار آخر اتم آنهاست.
در این طبقه بندی عنصرهایی که تعداد الکترون مدار آخر اتم آنها برابر است، در یک ستون قرار می گیرند.
بر این اساس دانشمندان عنصرها را از به ترتیب عدد اتمی در جدولی در 18ستون و 7 ردیف به صورت زیر طبقه بندی کرد ه اند
